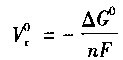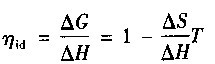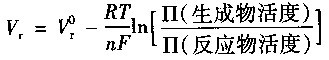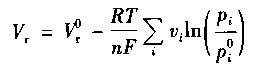有关于燃料电池的工作原理?
浏览数量: 49 作者: 本站编辑 发布时间: 2021-01-27 来源: 本站
["wechat","weibo","qzone","douban","email"]
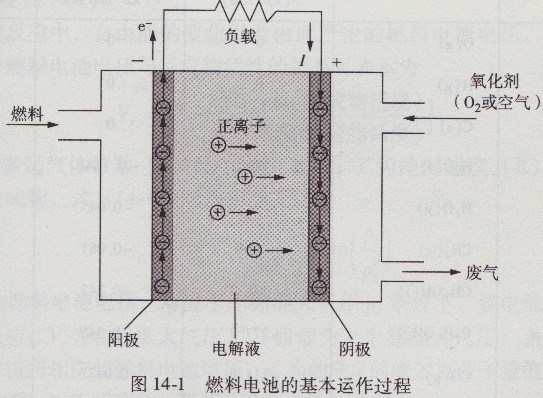
燃料电池是一种原电池,借助于电化学过程,其内部燃料的化学能直接转换为电能。燃料和氧化剂持续且独立地供给
电动汽车电池的两个电极,并在电极处进行反应。电解液必须用以为离子从一个电极传导至另一电极,如图14-1所示。
燃料供给阳极或正极,在该电极处,依靠催化剂,电子从燃料中释放。在两电极间电位差作用下,电子经外电路流向阴极或负极,在阴极处,正离子和氧结合,产生反应物或废气。
燃料电池中的化学反应类似于
蓄电池中的化学反应。燃料电池的热力学电压与反应中释放的能量和转移的电子数密切相关。被原电池反应所释放的能l量由吉布斯(Gibbs)自由能的变化量△G给出,通常以每摩尔克分子量予以表示。在化学反应中,该吉布斯自由能的变化可表示为
式中,Gi和Gj分别为生成物i和反应物j的自由能。在可逆反应过程中,△G完全转换为电能,即
式中,n为反应中转移的电子数;F= 96495为法拉第常数(C/mol);Vr为燃料电池的可逆电压。在标准状态下(温度25℃,1个标准大气压),原电池的开路(可逆)电压可表达为
式中,△G0为在标准状态下吉布斯自由能的变化量。△G可表示为
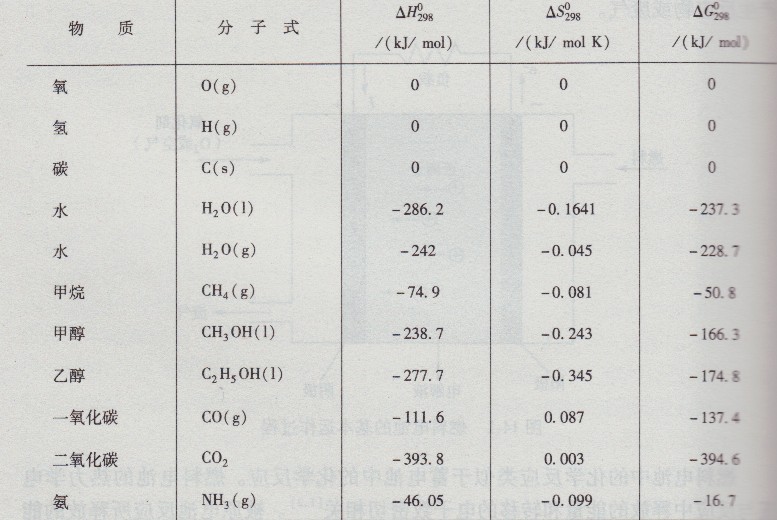
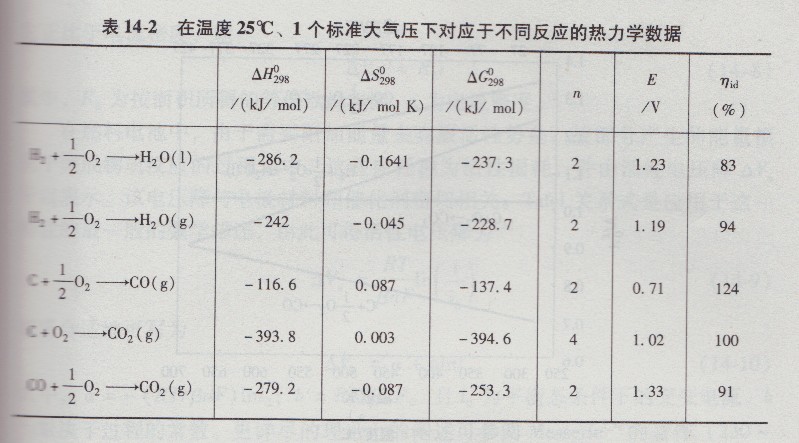
式中,△H和△s分别为绝对温度T时反应的焓变化和熵变化。表14-1给出了一些典型物质的标准焓、熵和吉布斯自由能值。表14-2给出了在温度25℃、1个标准大气压下,燃料电池某些反应中的热力学数据。
表14-1 典型燃料标准的生成焓和吉布斯自由能值
可逆原电池的“理想”效率与原电池反应所对应的焓关联如下:
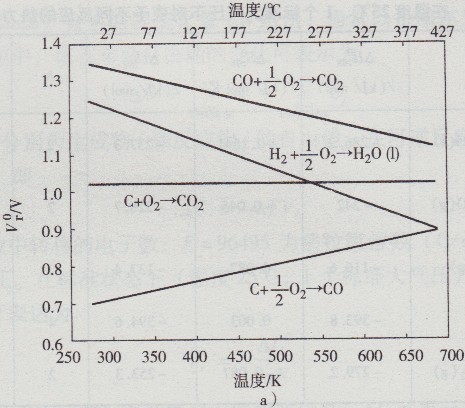
若电化学反应不涉及气体摩尔克分子量值的变化,即当△S为零时,则μid将为100%。例如,C+02=C02的反应即是这一情况。然而,若熵变化△S反应为正向,则原电池内在等温且可逆情况下进行的反应,按其配置不仅有化学能△H,而且有为转换成电能从周围环境所吸收的热量T△S(类似于热泵)(见表14-2)(见图14.2)。
在化学反应中,自由能的变化以及由此产生的燃料电池电压,均为溶质活性的函数。燃料电池电压与反应物活性的关系可表示为
式中,R为普适气体常数[8. 31J/(mol·K)];T为绝对温度(K)。对于气态反应物和生成物,式(14-6)可表示为
式中,Vr燃料电池电压,对应于非标准大气压Pi条件下,该
电动汽车电池内气态参与物进行的反应;Vor标准大气压Pio(通常为1个标准大气压)条件下,所有气体参与反应所相应的燃料电池电压;Vi为物质i的摩尔克分子量值(对于生成物.其值为正;对于反应物,其值为负)。